REPORT 009
2017.12
がん新薬の闇
がんの新薬は、製薬会社に莫大な利益をもたらします。
たとえば「分子標的薬」である「アバスチン」は、大腸がんへの使用が2004年に米国で承認されたのを皮切りに、世界各国で種々のがん種への使用が認められ、世界の累積売上高は2014年で4兆3000億円!
日本では大腸がん以外に、肺がん、乳がん、子宮がん、卵巣がん、脳腫瘍での使用が承認されており、2016年の国内売上高は920億円。
しかし、アバスチンは無効かつ有害です。
クスリとして承認したのは間違いです。
「比較試験」がそれを教えてくれます。
下図は、臓器転移がある大腸がん患者を対象とした比較試験の結果です。
患者を2班に分けて、片方にアバスチンを、他方に「プラセボ(偽薬)」を投与しています(以下、「A試験」と称す)(Oncology 2010;78:376)。
グラフではプラセボ群より、アバスチン群の生存期間が少し短いように見えます。
これではアバスチンは「無効」というしかありません。
なおこの試験では、同時に抗がん剤も投与されています。
全員に投与しているので、抗がん剤の影響は無視でき、アバスチンとプラセボの効力を比較したことになります(ただし抗がん剤に意味があるかは別問題。大腸がんのような固形がんへの抗がん剤は無意味・有害です→レポート④参照)。
そもそもアバスチンは、がんに存在する「特殊なたんぱく質だけを狙うクスリ」という触れこみで、「分子標的薬」と呼ばれます。
正常細胞まで無差別に攻撃する「抗がん剤」とは異なり、副作用が少ないと期待されました。
でも実際には、標的になる分子(たんぱく質)はいろいろな正常組織に存在しており、そのため重篤な副作用が生じます。
たとえば、ショック、消化管の穿孔(穴が開いて腹膜炎になる)、脳出血や消化管出血、心筋梗塞、脳梗塞…などなどです。どれも死亡することがあります。
A試験でアバスチン群の生存期間が短くなっているのも、副作用で命を縮めている可能性がある。……こういう体たらくで4兆3000億円はないでしょう。
このようにダメな新薬が、なぜ承認されたのでしょうか。
それも比較試験が理由です。
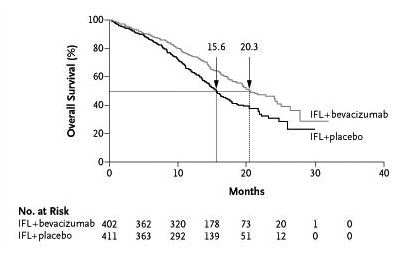
図2はA試験と同じく臓器転移がある大腸がん患者を対象とした比較試験の結果です(以下、「B試験」と称す)(N Engl J Med 2004;350:2335)。
グラフにある、プラセボ群の「15.6か月」と、アバスチン群の「20.3か月」は、患者さんの半数が亡くなるまでの期間です。
専門的には「生存期間中央値」といい、つまりは「半数死亡期間」です。
この試験では、アバスチンで余命が延びており、「延命効果があった」と判定されます。
なぜA試験とB試験とで、矛盾した結果がでたのでしょうか。
両試験とも、転移がある大腸がんが対象で、アバスチンやプラセボのほかに、全員に抗がん剤が投与されている点も同じです。
A試験はギリシャの大規模ながん専門病院で実施され、B試験は米国、オーストラリア、ニュージーランドの164病院で施行されている点は異なります。
しかし比較試験の場合、かりに医療水準に違いがあったとしても、結果に影響を与えません(それで、数十か国が参加した比較試験も行われる)。
両試験の唯一にして最大の違いは、A試験は製薬会社がからんでいないのに対し、B試験は製薬会社の主導かつ資金によって行われている点でしょう。
下記は、B試験論文の著者たちの名前で、試験実施の責任者です。
H Hurwitz, L Fehrenbacher, W Novotny, T Cartwright, J Hainsworth, W Heim, J Berlin, A Baron, S Griffing, E Holmgren, N Ferrara, G Fyfe, B Rogers, R Ross, F Kabbinavar
緑色にした名前が、製薬会社から「研究費」「講演料」「顧問料」など資金の提供をうけている医師たちです。
赤色は、驚くなかれ、製薬会社の社員です。
試験の実施、データの収集・解析、論文執筆のあらゆる段階で社員が関与しているので、インチキをしようと思えば、し放題でしょう。
承認用の比較試験では「有効」、その後に医師たちが独自に行う試験では「無効」になる理由です。
ところで最初に実施されたのはB試験で、その結果に依拠してアバスチンは承認されました。A試験はその後に施行されたものです。
新薬として一度承認・発売されると、その後に無効であることがわかっても、承認が取り消されることはないのです。
「免疫チェックポイント阻害剤」のオプジーボも、承認用の試験では「有効」、その後の試験では「無効」でしたが、承認は取り消されずにいます(→レポート②参照)。
それどころか、承認用の比較試験で「無効」とわかっても、承認されることが現にあります。
乳がんに対するアバスチンがその例です。
下図は、臓器転移がある乳がん患者における比較試験の結果です。
全員に抗がん剤治療がおこなわれ、半数にプラセボ、他の半数にアバスチンが投与されています(アバスチン・インタビューフォーム)。
厚生労働省は、この結果を根拠として2011年に、乳がんへのアバスチン使用を承認したのです。
このように厚生労働省は、患者から、国庫から、お金を収奪して医薬業界に分配しています。
その結果、患者たちの健康が害され、数多くの死人がでています。
新薬承認の闇は深すぎます(今後も本レポートで解明予定)。